
N6-甲基腺嘌呤(N6-methyladenosine, m6A)是真核生物RNA上含量最为丰富的转录后修饰,具有添加和擦除可逆的特征,已被视为重要的RNA层级表观遗传调控而得到广泛研究。近年来,重复序列(repeat)尤其是逆转录转座子(retrotransposon)在调控早期胚胎发育、多能干细胞特性中的功能受到越来越多的关注,例如long interspersed nuclear element-1 (LINE1)RNA就被证明能够招募NCL-KAP1蛋白形成脚手架复合物(scaffold complex),调控二细胞(2-cell, 2C)相关转录本的表达以及rRNA合成【1】。
虽然已有研究证明了m6A通过促进repeat RNA的降解来调控染色质状态和转录活性(Science | 何川/韩大力/高亚威合作发现m6A调控染色质状态和转录)【2】,但m6A在功能性染色质相连RNA(chromatin-associated regulatory RNA, carRNA)的反式调控机制中扮演了怎样的角色尚不明晰。
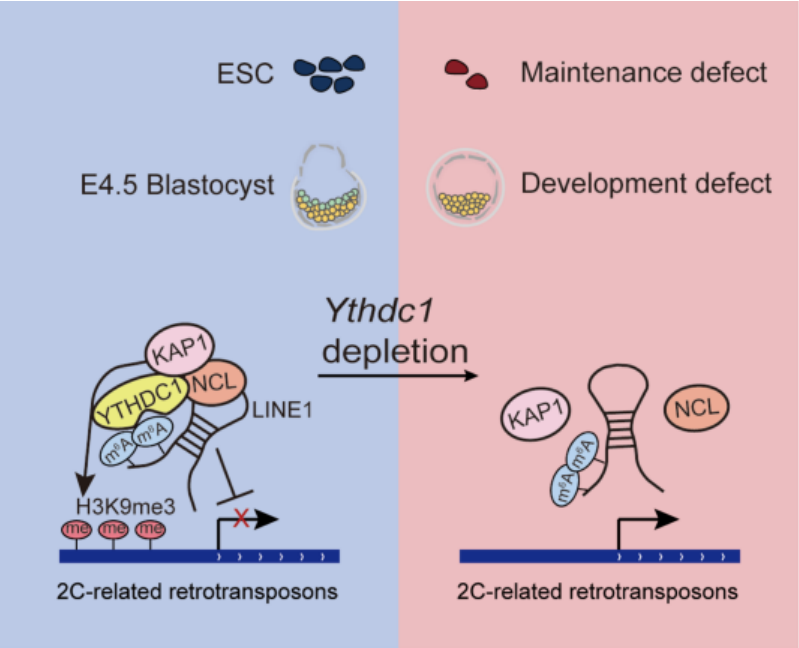
2021年4月22日,同济大学高绍荣/高亚威团队与南京医科大学沈彬组合作在Protein & Cell在线发表了题为Nuclear m6A reader YTHDC1 regulates the scaffold function of LINE1 RNA in mouse ESCs and early embryos 的研究长文(Research Article)。这项工作揭示了细胞核内的m6A识别蛋白YTHDC1在小鼠胚胎干细胞(embryonic stem cell, ESC)维持和早期胚胎发育中的重要作用,YTHDC1通过结合LINE1 carRNA上的m6A修饰,促进NCL-KAP1蛋白招募到LINE1调控复合物中,从而保障2C相关逆转录转座子上的H3K9me3建立和转录抑制。

该文作者首先发现Ythdc1对于小鼠ESC的自我更新、克隆形成至关重要,且这种作用高度依赖于YTHDC1蛋白识别m6A的能力。深入分析显示, LINE1 RNA上同时有着高度富集的YTHDC1结合及m6A修饰,之前研究已经证明YTHDC1通过识别LINE1 carRNA上甲基转移酶METTL3建立的m6A修饰来促进RNA降解【2】,然而本文作者发现LINE1 carRNA上的一些m6A可能并非依赖于METTL3写入,且这些METTL3非敏感型m6A虽然也能被YTHDC1识别,但其存在并未促进RNA降解。值得注意的是,LINE1 RNA敲降引发的细胞增殖障碍和转录组缺陷同样出现在Ythdc1敲除ESC中,尤其是2C相关基因和逆转座子的上调以及rRNA的下调,而这些表型并未出现在Mettl3敲除ESC中,这说明LINE1 carRNA上的METTL3非敏感型m6A在被YTHDC1识别后很可能影响了LINE1调控染色质状态的scaffold功能。进一步研究发现,YTHDC1与LINE1复合物中的调控因子NCL和KAP1均存在蛋白间相互作用,而Ythdc1的缺失减弱了NCL对LINE1 RNA的结合,并抑制了LINE1复合物靶点上KAP1的招募,造成KAP1介导的H3K9me3建立障碍,使得包括2C相关逆转录转座子在内的位点转录去抑制化。研究者最后证明了YTHDC1对2C相关逆转座子H3K9me3建立和转录抑制的调控同样存在于小鼠囊胚的内细胞团(inner cell mass, ICM)中。
该研究证明了m6A参与了LINE1 RNA对染色质状态的调控,其中YTHDC1作为m6A识别蛋白,促进了carRNA在RNA和染色质交互(cross-talk)中的桥梁作用。这项工作也提示了可能存在更多的RNA转录后修饰调控carRNA功能的机制,为后续carRNA调控转录活性和染色质开放程度的研究提供了新的思路。
同济大学直博生陈川和研究员刘文强为本文的共同第一作者,同济大学高绍荣教授、高亚威教授及南京医科大学沈彬教授为本文的共同通讯作者。该工作还受到北京大学刘君研究员和芝加哥大学何川教授课题组豆晓阳博士的支持与合作。
值得一提的是,不久前中国科学院广州生物医药与健康研究院陈捷凯课题组在Nature发表题为The RNA m6A reader YTHDC1 silences retrotransposons and guards ES cell identity的研究论文(专家点评Nature | 陈捷凯团队揭示m⁶A阅读蛋白YTHDC1通过沉默逆转录元件调控细胞命运),该文章的结论与高绍荣团团队的研究工作相似,研究报道在小鼠胚胎干细胞中,RNA m6A通过其核内阅读器蛋白YTHDC1调控H3K9me3和异染色质形成,从而沉默逆转录转座子元件并限制该细胞转化为2C-like细胞。此外,复旦大学的表观遗传团队也发表了题为METTL3 regulates heterochromatin in mouse embryonic stem cells的论文(详见BioArt报道:Nature | 复旦表观团队揭示METTL3调控小鼠胚胎干细胞异染色质形成机制),从m6A甲基化酶METTL3入手发现了类似的机制。
原文链接:
https://link.springer.com/article/10.1007/s13238-021-00837-8
 |
同济大学高绍荣课题组 地址:上海市四平路1239号同济大学,道交馆 邮编:200092 电话:021-65982276 |