
2021年2月25日,来自同济大学生命科学与技术学院高绍荣教授领导的团队在Stem Cell Reports杂志上发表了题为“Unique Patterns of H3K4me3 and H3K27me3 in 2-Cell-like Embryonic Stem Cells”的研究成果。该研究在小鼠的二细胞胚胎样干细胞中进行了染色质免疫共沉淀实验,与转录组信息相结合,分析比较了普通胚胎干细胞,二细胞胚胎样胚胎干细胞和二细胞胚胎的全基因组H3K4me3和H3K27me3组蛋白修饰图谱。二细胞胚胎样干细胞中的大多数基因继承普通胚胎干细胞的组蛋白修饰模式。在二细胞样转换过程中表现为组蛋白甲基化状态发生转换的基因中,只有少数可以获得二细胞胚胎的表观遗传学特征。相反,宽广的H3K4me3在二细胞胚胎样干细胞中呈现广泛的丢失。大多数差异表达基因在二细胞胚胎样干细胞中的H3K4me3和H3K27me3水平降低,而从头H3K4me3沉积与二细胞胚胎特异性基因表达水平密切相关。该研究揭示了二细胞胚胎样干细胞的独特表观遗传学特征,有利于将来对全能性的进一步探索。

受精后的胚胎会发生广泛的表观遗传重编程,这一过程对全能性的恢复起着至关重要的作用(Xu and Xie, 2018)。合子基因组激活(ZGA)与表观遗传重编程和全能性的获得密切相关(Lu and Zhang,2015)。 在小鼠中,ZGA主要发生在二细胞胚胎阶段(Bouniol et al.,1995; Schultz,1993)。破坏ZGA基因的严格控制会导致胚胎发育异常和疾病的发生(Falco et al.,2007; Gabriels et al.,1999; Geng et al.,2012; Guo et al.,2019)。虽然近阶段的研究已经取得了长足的进步,但仍存在大量有待解决的问题,而且早期胚胎的稀缺严重阻碍了全能性分子基础的研究。
最近,有研究报道指出极少部分的胚胎干细胞能够瞬时进入类似于二细胞胚胎的状态(Macfarlan et al.,2012; Zalzman et al.,2010)。在这些二细胞胚胎样干细胞中,二细胞胚胎特异性的基因和重复序列(例如Dux,Zscan4基因簇和MERVL)高度上调(Macfarlan et al.,2012)。除此之外,这些细胞还具有类似于二细胞胚胎的染色质结构(Eckersley-Maslin et al.,2016; Ishiuchi et al.,2015)。除了具有独特的分子特征外,二细胞胚胎样干细胞还显示出对胚内和胚外谱系都有贡献的能力(Macfarlan et al.,2012)。二细胞胚胎样干细胞的鉴定为了解ZGA的机理和全能性的分子基础提供了新的机会。
为了进一步探索全能性的表观遗传学特征,高绍荣课题组在二细胞胚胎样干细胞中绘制了H3K4me3和H3K27me3的全基因组图谱,并在二细胞胚胎,二细胞胚胎样干细胞和胚胎干细胞之间进行了详细的比较。首先,研究人员发现二细胞胚胎样干细胞与普通胚胎干细胞的基因启动子处具有相似的组蛋白甲基化状态,这与二细胞胚胎中的情况不同。其中只有一小部分基因获得了类似于二细胞胚胎的组蛋白甲基化标记。与组蛋白甲基化位点的保留相反,在二细胞胚胎样干细胞中观察到广泛的H3K4me3结构域大量丢失。另外,在二细胞胚胎样干细胞中,上调基因之间的H3K27me3和H3K4me3水平改变的模式是多样的。同时,还发现在高度上调的二细胞胚胎基因(包括Zscan4和Dux)的启动子区域中观察到从头H3K4me3沉积。
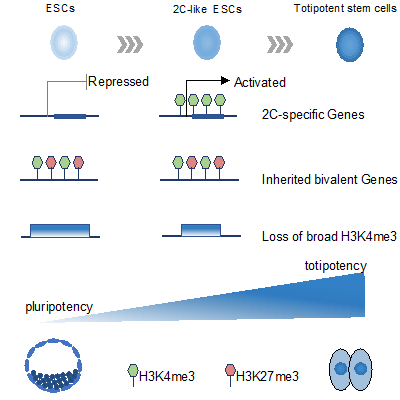
综上所述,这项研究提供了二细胞胚胎,二细胞胚胎样干细胞和胚胎干细胞之间表观遗传特性的详细比较,表明在启动子区域,二细胞胚胎样干细胞的H3K4me3和H3K27me3修饰模式与二细胞胚胎的不同,更近似于胚胎干细胞。未来,进一步探索重编程二细胞胚胎样干细胞表观基因组有关的表观遗传因素,可能有助于我们了解ZGA和全能性的分子机制。
同济大学高绍荣课题组助理研究员张艳平、直博生黄忆鑫为该论文的共同第一作者,高绍荣教授、乐融融助理教授为共同通讯作者。该研究得到了科技部重点研发计划、国家自然科学基金委、上海市科委等项目的支持。
文献引用
Bouniol, C., Nguyen, E., and Debey, P. (1995). Endogenous transcription occurs at the 1-cell stage in the mouse embryo. Exp. Cell Res. 218, 57–62.
Eckersley-Maslin, M.A., Svensson, V., Krueger, C., Stubbs, T.M., Giehr, P., Krueger, F., Miragaia, R.J., Kyriakopoulos, C., Berrens, R.V., Milagre, I., et al. (2016). MERVL/Zscan4 network activation results in transient genome-wide DNA demethylation of mESCs. Cell Rep. 17, 179–192.
Falco, G., Lee, S.L., Stanghellini, I., Bassey, U.C., Hamatani, T., and Ko, M.S. (2007). Zscan4: a novel gene expressed exclusively in late 2-cell embryos and embryonic stem cells. Dev. Biol. 307, 539–550.
Gabriels, J., Beckers, M.C., Ding, H., De Vriese, A., Plaisance, S., van der Maarel, S.M., Padberg, G.W., Frants, R.R., Hewitt, J.E., Collen, D., et al. (1999). Nucleotide sequence of the partially deleted D4Z4 locus in a patient with FSHD identifies a putative gene within each 3.3 kb element. Gene 236, 25–32.
Geng, L.N., Yao, Z., Snider, L., Fong, A.P., Cech, J.N., Young, J.M., van der Maarel, S.M., Ruzzo, W.L., Gentleman, R.C., Tawil, R., et al. (2012). DUX4 activates germline genes, retroelements, and immune mediators: implications for facioscapulohumeral dystrophy. Dev. Cell 22, 38–51.
Guo, M., Zhang, Y., Zhou, J., Bi, Y., Xu, J., Xu, C., Kou, X., Zhao, Y., Li, Y., Tu, Z., et al. (2019). Precise temporal regulation of Dux is important for embryo development. Cell Res. 29, 956–959.
Ishiuchi, T., Enriquez-Gasca, R., Mizutani, E., Boskovic, A., ZieglerBirling, C., Rodriguez-Terrones, D., Wakayama, T., Vaquerizas, J.M., and Torres-Padilla, M.E. (2015). Early embryonic-like cells are induced by downregulating replication-dependent chromatin assembly. Nat. Struct. Mol. Biol. 22, 662–671.
Lu, F., and Zhang, Y. (2015). Cell totipotency: molecular features, induction, and maintenance. Natl. Sci. Rev. 2, 217–225.
Macfarlan, T.S., Gifford, W.D., Driscoll, S., Lettieri, K., Rowe, H.M., Bonanomi, D., Firth, A., Singer, O., Trono, D., and Pfaff, S.L. (2012). Embryonic stem cell potency fluctuates with endogenous retrovirus activity. Nature 487, 57–63.
Schultz, R.M. (1993). Regulation of zygotic gene activation in the mouse. Bioessays 15, 531–538.
Xu, Q., and Xie, W. (2018). Epigenome in early mammalian development: inheritance, reprogramming and establishment. Trends Cell Biol. 28, 237–253.
Zalzman, M., Falco, G., Sharova, L.V., Nishiyama, A., Thomas, M., Lee, S.L., Stagg, C.A., Hoang, H.G., Yang, H.T., Indig, F.E., et al. (2010). Zscan4 regulates telomere elongation and genomic stability in ES cells. Nature 464, 858–863.
 |
同济大学高绍荣课题组 地址:上海市四平路1239号同济大学,道交馆 邮编:200092 电话:021-65982276 |