
受精卵起始于精卵的融合。随后父、母源基因组经历了剧烈的表观遗传学重编程过程。其中组蛋白H3K27甲基化(包括H3K27me2和H3K27me3)作为异染色质和基因沉默的标志,其动态变化对于哺乳动物胚胎正常发育至关重要,近年来也得到研究者们的持续关注。然而受精卵中H3K27me2和H3K27me3是如何建立以及调控的机制仍未得到系统的研究。
2020年12月11日,广东省第二人民医院孙青原和欧湘红课题组、同济大学高绍荣课题组、中国科学院动物研究所王震波课题组合作在 Nature Communications 杂志上合作发表论文:PRC2 and EHMT1 regulate H3K27me2 and H3K27me3 establishment across the zygote genome,首次系统性地研究了小鼠受精卵中H3K27me2和H3K27me3建立与调控的机制,并结合微量测序技术ULI-NChIP描绘出H3K27me2在受精卵中的分布模式。

关于H3K27me3,清华大学颉伟课题组利用STAR ChIP-seq展示了其受精前后在基因组上的动态模式;哈佛大学张毅课题组发现母H3K27me3可以作为一种可遗传的表观遗传修饰,以非DNA甲基化依赖的方式影响父母源基因组的等位基因特异性表达。H3K27的甲基化除了H3K27me3外还有H3K27me2,这两种修饰之间是否存在关联,以及在小鼠卵母细胞和受精卵基因组上两者是如何建立与调控的呢?H3K27的甲基化是PRC2复合体负责的,然而其核心组分EZH2和EED分别在小鼠卵母细胞特异性敲除后表型迥异:前者发育迟缓,后者生育力显著下降且过度生长。这暗示着其调控机制的独特性、功能的重要性和机制的独特性。
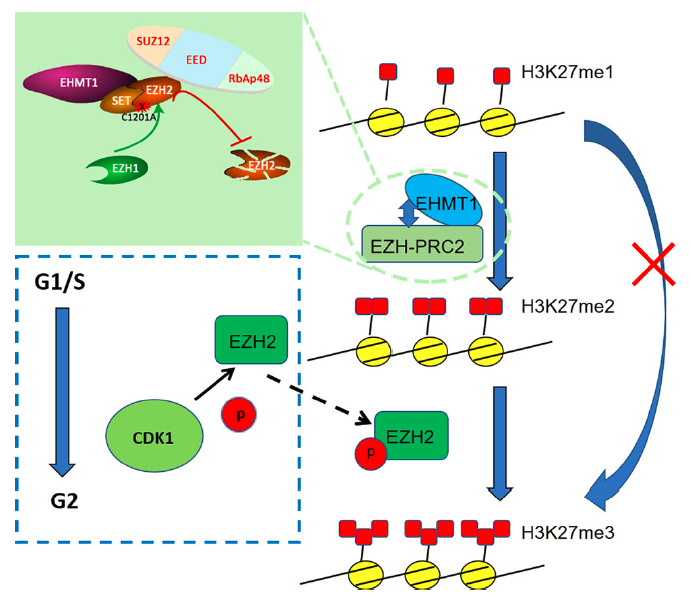
在这一工作中,研究人员通过多种基因条件敲除小鼠模型、RNAi、免疫荧光染色、Co-IP以及新的微量测序技术 ULI-NChIP等手段,系统性研究了H3K27me2和H3K27me3在小鼠卵母细胞、受精卵和早期胚胎发育过程中建立与调控的机制。研究者发现:1)母源EZH2对于H3K27me3的建立是必须的;2)微量测序技术ULI-NChIP显示H3K27me2在基因组上是一种广泛的分布模式;3)EZH1可以部分保障EZH2在H3K27me2形成中的作用;4)值得注意的是,研究者发现在着床前胚胎发育过程中H3K27me2的建立存在一种从不依赖EZH2 / EED到依赖EZH2 / EED的转换机制;5)进一步研究揭示了EHMT1而非EHMT2参与H3K27me2的建立与调控过程,确定了雄原核新生H3K27me3的建立必须以H3K27me2作为底物,从而阐明了H3K27me2和H3K27me3之间的关系;6)此外,发现该调控模式存在细胞周期依赖性。
综上所述,这一工作详细描绘并确认了小鼠受精卵中组蛋白H3K27me2和H3K27me3的关系及建立调控机制。
据悉,中国科学院动物研究所和广东省第二人民医院合作培养博士后孟铁刚、中国科学院动物研究所周茜博士、郑州大学第一附属医院马雪山博士和同济大学刘晓雨教授为并列第一作者。
原文链接:
https://www.nature.com/articles/s41467-020-20242-9
 |
同济大学高绍荣课题组 地址:上海市四平路1239号同济大学,道交馆 邮编:200092 电话:021-65982276 |