
CRISPR-Cas9介导的基因打靶技术在基础研究及临床转化领域均展现出令人欣喜的前景,然而CRISPR-Cas9系统的打靶效率问题会阻碍其进一步投入实际应用。当Cas9在基因组特定位点诱发DNA双链断裂后,后续修复方式的选择将决定最终的打靶产物:只有成功进行同源重组(HR)才可完成外源基因的打靶,而发生非同源末端连接(NHEJ)则会引发基因敲除。因此,领域内认为:如果可以人为操纵Cas9切割DNA后的双链断裂修复选择偏向,理论上就可以改变基因靶向整合的效率。
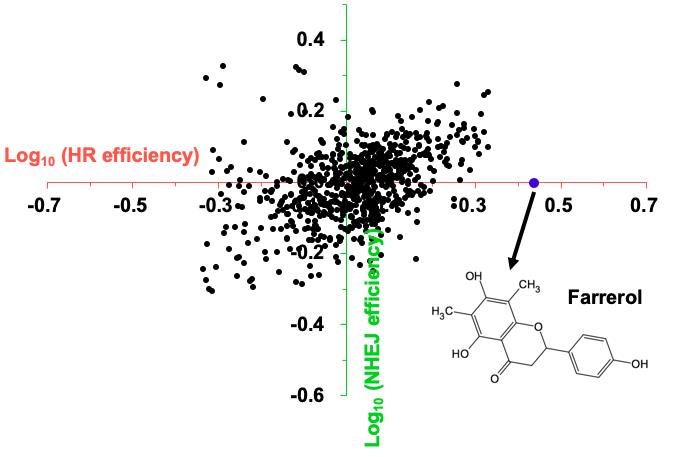
近日,同济大学生命科学与技术学院毛志勇教授课题组与高绍荣教授课题组合作在《eLife》期刊在线发表了题为“A high-throughput small molecule screen identifies farrerol as a potentiator of CRISPR/Cas9-mediated genome editing”的论文。该研究中,团队成员构建了一种可由多西环素诱导内切酶I-SceI表达的载体,并将其整合到团队前期构建的双色荧光DNA双链断裂修复报告细胞株中(Nucleic Acids Research, 2019),建立了一种新型的基于DNA修复效率分析的高通量药物筛选平台。研究者可实现简单快速地通过多西环素诱导基因组特定位点发生双链断裂,并基于流式细胞技术分析细胞荧光,从而判断细胞内的DNA双链断裂修复情况。利用这一系统,团队成员筛选了722种来源于中草药的天然小分子化合物,并发现杜鹃素(farrerol)可显著促进HR修复,而对NHEJ修复无明显影响。
基于此,研究团队在不同系统中检测了杜鹃素对CRISPR-Cas9介导的同源重组靶向整合效率的影响,结果表明:杜鹃素在人和小鼠细胞中多个基因组位点能够实现更有效精确地靶向整合。此外,杜鹃素在小鼠胚胎水平也能够有效促进靶向整合效率,而得到的靶向整合小鼠亦能保留生殖系传递的能力。更重要的是,杜鹃素可以通过促进重组酶RAD51的快速招募,进而提高HR修复中的较为精确的亚通路——基因转换(gene conversion)或者交换(crossover)——的效率,而对可能造成重复序列重组的单链退火(single strand annealing)通路具有显著的抑制作用。此外,该小分子化合物对不同细胞的基因组稳定性、核型及胚胎发育都没有显著的负面影响,而目前被广泛使用的促进CRISPR-Cas9介导的基因靶向整合的小分子SCR7及RS-1均表现出了不同程度的基因或发育毒性。
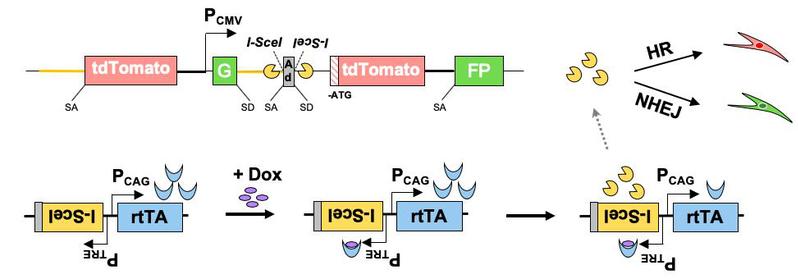
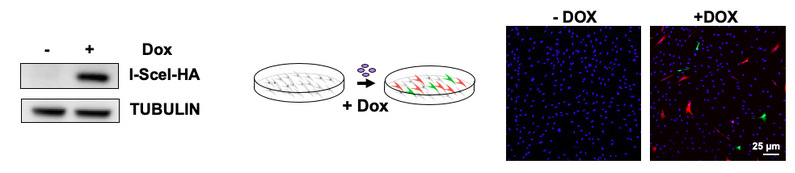
合作团队建立的高通量筛选系统具备多种优势:(1)DNA双链断裂修复受细胞周期影响极大,而转染本身会对细胞周期造成一定影响。由于该系统只需加入多西环素即可诱发双链断裂,而不需任何外源基因的转染,因此避免了由转染对DNA修复造成的潜在干扰; (2)本系统可配合流式细胞技术或高内涵筛选系统进行高效客观的定量分析;(3)筛选得到的影响两个DSB修复途径效率的化合物不仅可用于操纵Cas9打靶效率,还具有其他多项潜在应用价值。如可利用抑制DNA修复的小分子药物特异靶向癌症或与其他方法进行联合靶向治疗,以及利用促进DNA修复的小分子药物通过改善基因组完整性来延缓衰老发生。
毛志勇教授课题组长期致力于衰老及其相关疾病的DNA修复变化、调控机制及靶向干预的研究。本次研究中建立的基于DNA修复能力检测的新型药物筛选平台将促进后续开发靶向DNA修复的新型小分子药物,进而延缓衰老及相关疾病的发生。本次研究中发现的小分子——杜鹃素可以通过提高HR修复效率促进不同物种、不同位点的靶向整合效率,且具备较低的细胞和胚胎毒性,因此展现了重要的转化应用潜力。
同济大学生命科学与技术学院博士研究生张伟娜、陈御为本文的共同第一作者。同济大学生命科学与技术学院毛志勇教授、高绍荣教授和陈嘉瑜副教授为本文的共同通讯作者。毛志勇课题组的硕士研究生杨佳庆、张晶、于佳钰及蒋颖副教授,高绍荣教授课题组的王梦婷,魏珂教授课题组的赵晓东也参与了相关研究。该工作同时得到了同济大学魏珂教授、中国药科大学徐晓军教授以及同济大学附属第一妇婴保健院万小平教授的支持。该研究得到科技部,基金委和上海市科委及上海市教委等经费的资助。
原文链接: https://elifesciences.org/articles/56008
 |
同济大学高绍荣课题组 地址:上海市四平路1239号同济大学,道交馆 邮编:200092 电话:021-65982276 |