
人类胚胎在植入前的发育阶段中,DNA甲基化状态发生剧烈变化并从4细胞期出现细胞间的异质性。解析这一过程中DNA甲基化异质性的产生机制及其与细胞命运决定的关联对于理解表观遗传修饰在第一次细胞命运决定中的作用非常重要。但是,受限于植入前胚胎的取材限制与数据获取的技术难度,目前仍缺乏对这一问题的系统研究。利用计算生物学方法来解析DNA甲基化状态转换过程不依赖于上述限制,有望应用于系统性研究植入前胚胎中DNA甲基化异质性的产生机制。
2020年11月16日,同济大学张勇课题组和高绍荣课题组合作在Genome Biology发表题为 A DNA methylation state transition model reveals the programmed epigenetic heterogeneity in human pre-implantation embryos的文章。在这项研究中,张勇课题组构建了量化DNA甲基化状态随着细胞分裂而改变的计算生物学模型MethylTransition并推演了植入前胚胎中DNA甲基化异质性的程序化出现。
在该研究中,CpG位点上的DNA甲基化状态随着细胞分裂而改变的过程被细分为了三个步骤:DNA复制过程中的被动去甲基化、DNA甲基化修饰酶引起的DNA甲基化主动改变以及非姐妹染色单体重新组合过程中DNA甲基化状态的组合。通过引入表征不同DNA甲基化修饰活动活性的参数,该研究对细胞分裂前后不同DNA甲基化状态相互转换的概率进行了参数表示,进一步结合单细胞DNA甲基化组学数据实现了对上述参数的估计,从而定量化地反映了DNA甲基化修饰活动的活性。
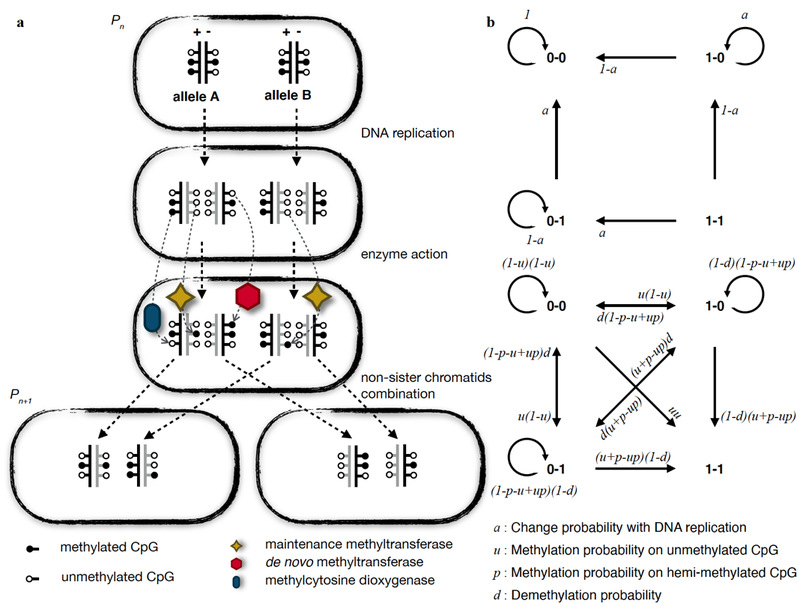
图.MethylTransition的计算框架示意图
该研究发现人类植入前胚胎中的DNA甲基化异质性很大程度上由合子时期的DNA甲基化状态决定,并应用构建的模型论证了DNA甲基化异质性程序化的产生。这一过程中,程序化的DNA甲基化异质性与转录异质性表现出正相关性,并具有时序上的关联性。进一步地,高绍荣课题组通过对比Stella-/-小鼠和野生型小鼠胚胎在8细胞时期的转录异质性支持了DNA甲基化异质性对基因表达异质性的影响。这些因DNA甲基化程度增加出现转录异质性增加的基因中,包括了Neat1等已报道的与首次细胞命运决定相关的关键因子,表明DNA甲基化的异质性可能参与首次细胞命运决定。这项研究提供了一种定量估计单次细胞分裂过程中DNA甲基化修饰活动活性参数的计算生物学方法,揭示了人类植入前胚胎中DNA甲基化异质性程序化产生的机制, 并为第一次细胞命运决定驱动因素的研究提供了线索。
张勇教授和高绍荣课题组刘文强副研究员为这篇文章的共同通讯作者。张勇课题组的赵程辰博士、山东大学的张乃千副研究员、高绍荣课题组的博士生张亚林为本文共同第一作者。这项研究得到了国家科技部、国家自然科学基金委、中组部、上海市科委等的资助。
论文链接:https://genomebiology.biomedcentral.com/articles/10.1186/s13059-020-02189-8
 |
同济大学高绍荣课题组 地址:上海市四平路1239号同济大学,道交馆 邮编:200092 电话:021-65982276 |