
2020年3月17日,我院高绍荣教授团队在Cell Reports发表题为“Identification of ALPPL2 as a naïve pluripotent state-specific surface protein essential for human naïve pluripotency regulation”的研究论文,首次鉴定出特异指征人naïve态多能性的功能性表面分子标志物ALPPL2,并发现其对于人类naïve态多能性的建立及稳定维持具有重要作用。针对ALPPL2作为人naïve多能干细胞特异功能性表面标志物的发现,高绍荣课题组已经申报并获批了中国发明专利。
Naïve多能性相关研究是近年干细胞及重编程领域研究的热点及难点。人类naïve 态多能干细胞由于具有更强的可塑性,在发育生物学、再生医学、药物筛选、疾病研究与治疗等方面拥有巨大的应用前景。因此,能特异性指征naïve态多能性的表面分子标志物的鉴定和发现,将为naïve态多能细胞的分离、提纯以及naïve态诱导和培养体系的进一步优化提供重要基础。
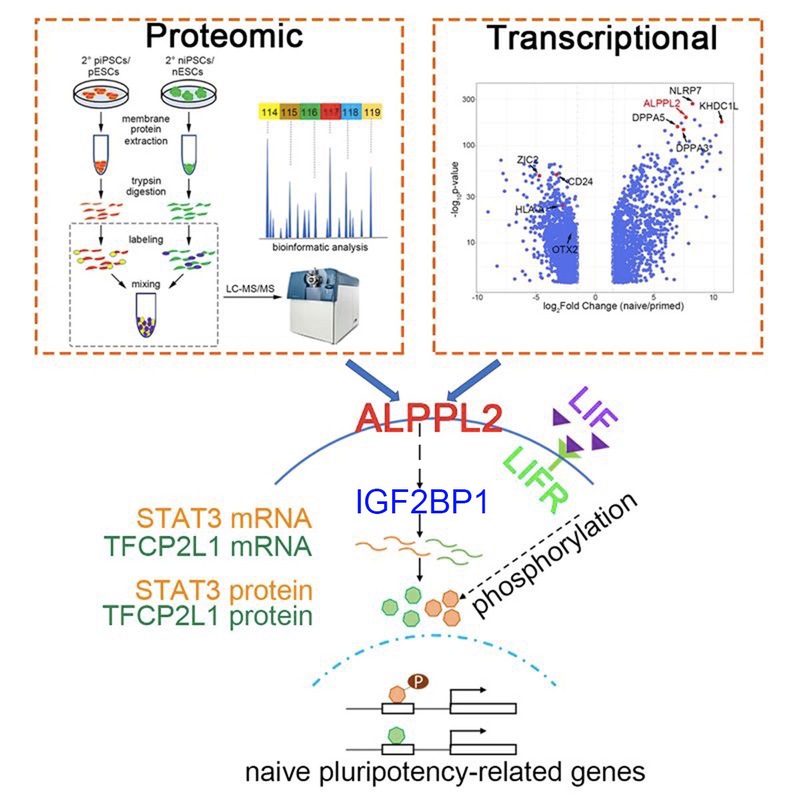
在本项研究中,研究人员以系统比较人naïve态及primed态多能干细胞的全膜蛋白表达差异为基础,运用iTRAQ-MASS定量技术及高通量测序组学分析技术,鉴定出naïve态多能性特异表面分子候选库。在蛋白质水平和转录组水平上对naïve态和primed态多能干细胞进行系统比较,发现ALPPL2特异的高表达于naïve态多能干细胞中。并且,在naïve态体细胞重编程、naïve-primed转化等系统中,利用ALPPL2启动子驱动的荧光报告系统可特异指征naïve态多能性的建立或退出,从而鉴定出ALPPL2为naïve态多能性的特异细胞表面标记物。进一步的研究发现,敲除ALPPL2会特异地影响naïve态多能性的建立、稳定及维持,证明ALPPL2蛋白是一个功能性的naïve态表面分子标志物。
接下来,研究人员利用免疫沉淀(IP)及免疫共沉淀(co-IP)实验,发现与ALPPL2的相互作用蛋白:RNA结合蛋白IGF2BP1。在naïve态多能干细胞中敲除IGF2BP1,会产生与ALPPL2敲除后相似的表型。RNA免疫共沉淀(RIP)实验发现,敲除ALPPL2会影响IGF2BP1对naïve态多能性特异基因STAT3和TFCP2L1 mRNA的稳定结合,从而导致STAT3及TFCP2L1 表达水平降低,进一步揭示了ALPPL2调控naïve态多能性的分子作用机理。
同济大学直博生毕焱和涂志奋为本文共同第一作者;本文的其他作者还包括张艳平助理研究员、杨鹏教授、博士生郭明岳、朱学昊、周建锋、赵程辰博士及王红老师;高绍荣教授,王译萱教授为本文的共同通讯作者。本研究得到了科技部、基金委和上海市科委的支持。
 |
同济大学高绍荣课题组 地址:上海市四平路1239号同济大学,道交馆 邮编:200092 电话:021-65982276 |