
N6-甲基腺苷(m6A)修饰与人类疾病息息相关,它通过影响包括细胞周期、细胞命运决定和细胞稳态等1生命进程的多个方面来调节人类疾病。m6A修饰的建立由Mettl3-Mettl14甲基转移酶复合物(MTC)催化2。通过Yamanaka因子(Oct4、Sox2、Klf4和c-Myc,称为OSKM)将体细胞重编程为诱导性多能干细胞(iPSCs)3,为研究细胞命运转变的分子机制提供了一个很好的研究系统。之前研究表明Mettl3的过量达可以增加m6A的水平,促进体细胞重编程为多能干细胞4,但Mettl14是否影响重编程以及相关作用机制尚不清楚。
2022年8月9日,同济大学生命科学与技术学院高绍荣团队在Stem Cell Reports杂志上在线发表题为Mettl14-driven senescence-associated secretory phenotype (SASP) facilitates somatic cell reprogramming的研究论文。该研究发现,作为甲基转移酶复合物组分的Mettl14以不依赖于m6A的方式促进重编程。利用高通量测序技术,发现Mettl14在重编程的后期明显上调了衰老相关分泌表型(SASP)基因的表达水平。这些SASP因子由未成功重编程的细胞分泌,并以旁分泌的方式促进其周围的细胞成功重编程成为iPSCs(图1)。
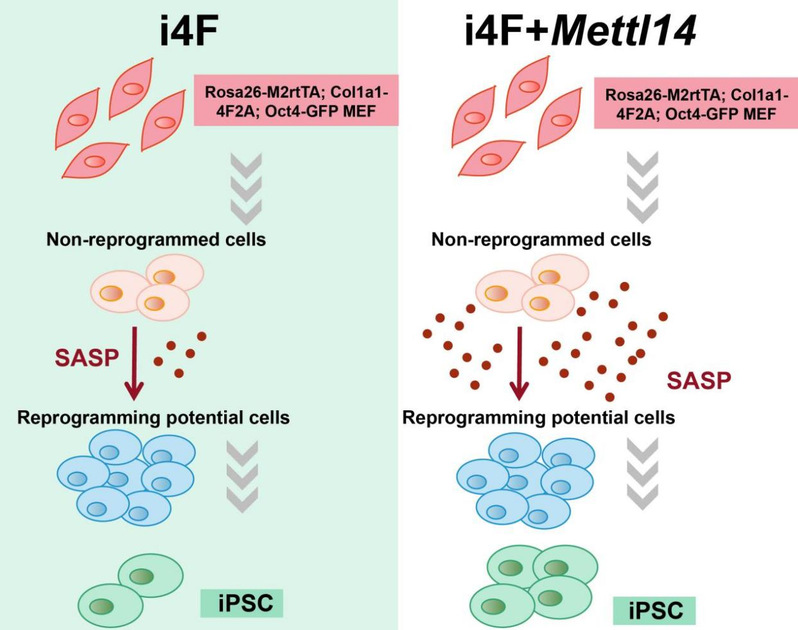
图1 Mettl14调控SASP基因
为了探究Mettl14对体细胞重编程的影响,研究者构建了过表达Mettl3、过表达Mettl14及其无活性形式的突变体质粒5(图2)。将其分别转染进重编程体系后发现,过表达Mettl3、Mettl14以及无活性形式的Mettl14突变体均可以显著提高重编程效率,提示Mettl14对重编程效率的调控不依赖于m6A修饰。
研究者在重编程过程的不同时间点,分别收集了对照组和过表达Mettl14 的样本来研究Mettl14促进重编程的机制,并进行了转录组测序(RNA-seq)。结果表明,在重编程第15天,过表达Mettl14上调的差异基因主要富集在免疫应答和细胞因子受体相互作用的基因簇。而之前的研究表明,在衰老细胞中,Mettl14以不依赖m6A修饰的方式调控SASP基因表达水平6。因此,研究者推测,在重编程晚期,Mettl14上调的这些基因为SASP基因。进一步研究发现,在重编程晚期,这些SASP基因的表达水平显著升高,但是,在建系的iPSC中几乎不表达。
为了进一步研究SASP与重编程的关系,研究者进行了细胞上清共培养实验及SASP因子共培养实验(图2)。结果表明,重编程过程的细胞上清或SASP因子(如IL6)可以促进重编程后期的细胞转变为多能干细胞。同时,对细胞进行碱性磷酸酶AP染色和β-Gal衰老染色后,发现多能性细胞与衰老细胞比例成正比,而加入衰老抑制剂后GFP阳性细胞与衰老细胞比例同时减少,表明重编程过程发生的衰老对重编程过程非常重要。通过对重编程后期的细胞进行流式分选并检测其中SASP基因表达水平发现,SASP基因在Oct4-GFP阴性细胞(未成功重编程的细胞)中的表达水平明显高于Oct4-GFP阳性细胞(成功重编程的细胞),研究者推断未成功转化为多能干细胞的的细胞群分泌了SASP因子,促进其周围细胞完成从体细胞向多能干细胞的转变。
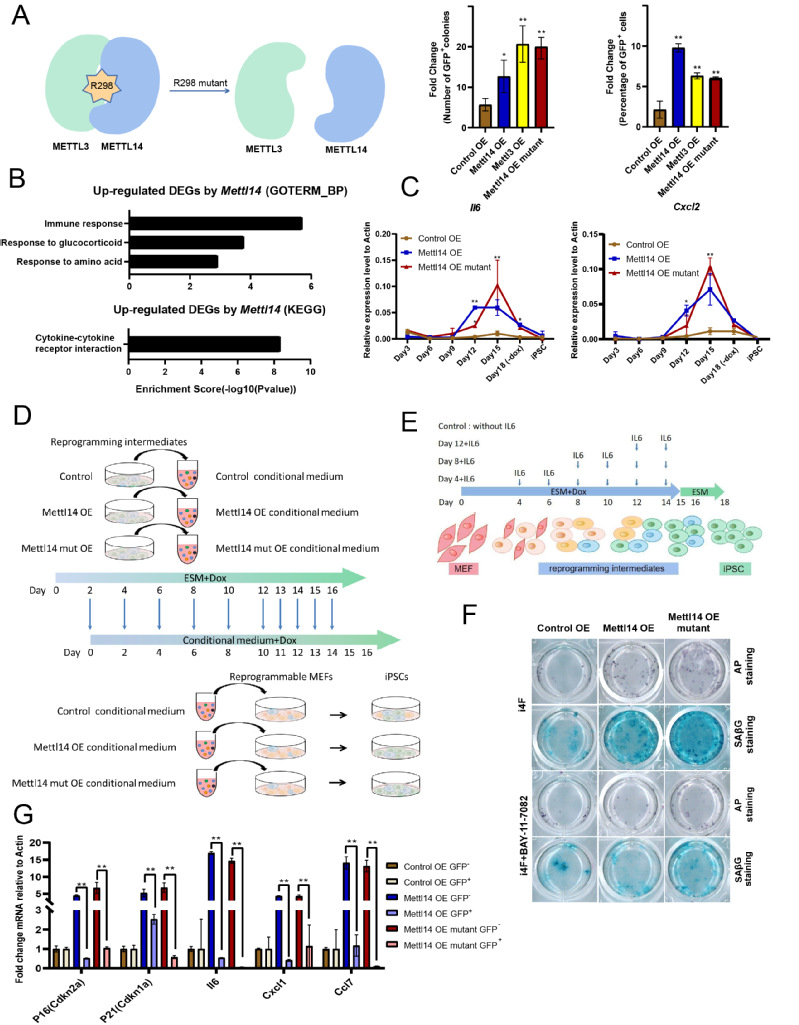
图2 体细胞重编程与细胞衰老的关系
综上所述,该研究揭示了Mettl3-Mettl14甲基转移酶复合物中,Mettl14对体细胞重编程的影响,验证了Mettl14在体细胞重编程过程中区别于Mettl3的作用机制,发现Mettl14在重编程诱导后期调控SASP基因表达水平,从而影响体细胞重编程的效率,同时,验证了体细胞重编程与细胞衰老的正相关关系。该研究为甲基转移酶独立于m6A修饰的功能及衰老相关分泌表型(SASP)和体外重编程之间的相互作用提供了新的见解。
本文的第一作者包括袭宸祥,孙嘉彤。高绍荣教授,吴丽副研究员,郝鲁江副教授是本文的共同通讯作者。该研究得到了国家自然科学基金委等项目的支持。
参考文献:
1 Batista, P.J., Molinie, B., Wang, J., Qu, K., Zhang, J., Li, L., Bouley, D.M., Lujan, E., Haddad, B., Daneshvar, K., et al. (2014). m(6)A RNA modification controls cell fate transition in mammalian embryonic stem cells. Cell Stem Cell 15, 707-719.
2 Wang, X., Feng, J., Xue, Y., Guan, Z., Zhang, D., Liu, Z., Gong, Z., Wang, Q., Huang, J., Tang, C., et al. (2016). Structural basis of N(6)-adenosine methylation by the METTL3-METTL14 complex. Nature 534, 575-578.
3 Takahashi, K., and Yamanaka, S. (2006). Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 126, 663-676.
4 Chen, T., Hao, Y.J., Zhang, Y., Li, M.M., Wang, M., Han, W., Wu, Y., Lv, Y., Hao, J., Wang, L., et al. (2015). m(6)A RNA methylation is regulated by microRNAs and promotes reprogramming to pluripotency. Cell stem cell 16, 289-301.
5 Wang, X., Feng, J., Xue, Y., Guan, Z., Zhang, D., Liu, Z., Gong, Z., Wang, Q., Huang, J., Tang, C., et al. (2016). Structural basis of N(6)-adenosine methylation by the METTL3-METTL14 complex. Nature 534, 575-578.
6 Liu, P., Li, F., Lin, J., Fukumoto, T., Nacarelli, T., Hao, X., Kossenkov, A.V., Simon, M.C., and Zhang, R. (2021). m(6)A-independent genome-wide METTL3 and METTL14 redistribution drives the senescence-associated secretory phenotype. Nat Cell Biol 23, 355-365.
 |
同济大学高绍荣课题组 地址:上海市四平路1239号同济大学,道交馆 邮编:200092 电话:021-65982276 |