
与传统的primed多能干细胞相比,人naïve多能干细胞捕获了体内胚胎植入前的发育特征,具有更高的可塑性和更好的分化潜能,为早期胚胎发育研究及临床应用提供了独特的模型和资源。目前获得人naïve多能干细胞主要有三种途径:通过植入前胚胎直接建立;将体细胞直接诱导重编程获得或者利用传统的primed态多能干细胞诱导转化形成。基于诱导条件的不断完善和优化,科学家实现了对naïve态多能干细胞分子特征的系统评估。然而对于naïve态建立过程中发生的关键分子生物学事件了解较有限。最近的一项研究首次描绘了人体细胞至naïve多能态过程中的分子重编程轨迹1,对于细胞从primed态多能性诱导成naïve态多能性过程中 (primed-to-naïve) 的细胞亚群变化及关键分子事件仍不清楚。
2022年6月7日, 同济大学生命科学与技术学院高绍荣/王译萱团队在Nature Communications上发表了题为 Cell fate roadmap of human primed-to-naive transition reveals preimplantation cell lineage signatures 的研究论文, 首次描绘了人primed-to-naïve转变中的细胞命运图谱, 并通过对过程中的关键生物学事件和细胞亚群的深度分析, 发现primed-to-naïve 转变过程中会出现滋养外胚层样 (TE-like) 和原始内胚层样 (PrE-like) 异质性细胞群体。
在前期研究中,研究人员鉴定了naïve态细胞特异的表面标志物ALPG蛋白,建立了ALPG-promoter-RFP报告系统,与公认的OCT4-ΔPE-GFP系统相整合建立了精准指征naïve态多能性的双荧光报告系统2。在本研究中,研究人员首先将该报告系统整合至primed态多能干细胞中诱导完成naïve态转化,并通过对过程中不同时间点的细胞进行流式分析,描绘了naïve多能性建立过程中标志分子表达动态图谱。
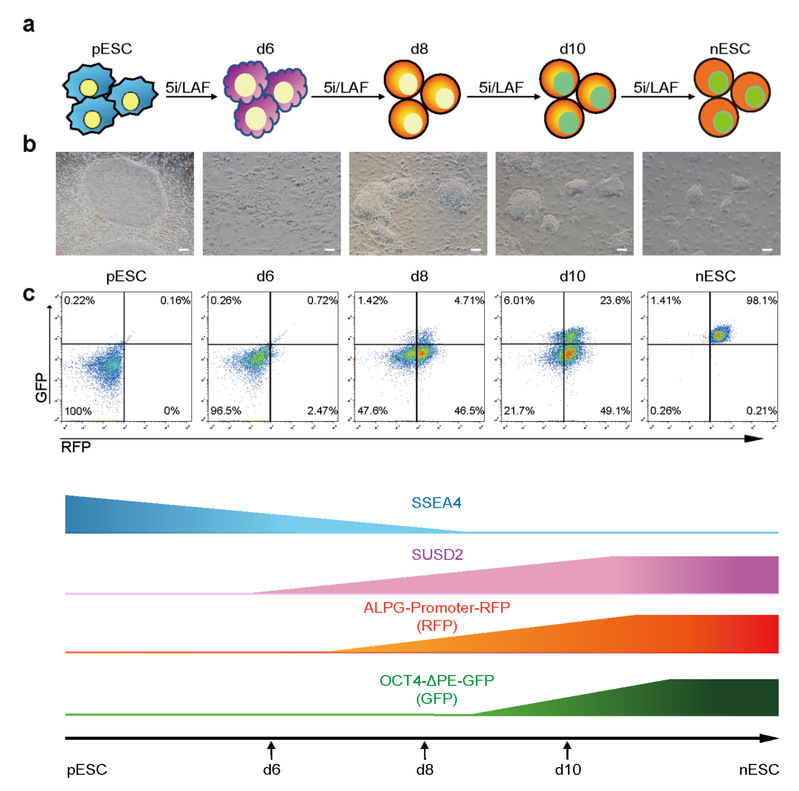
随后,他们收集不同时间点上具有不同荧光信号的细胞亚群进行了大量RNA-seq和ATAC-seq分析,发现在primed-to-naïve过程中,细胞亚群分别展示出了特异性的TE特征和PrE特征,伴随着TE基因 (GATA2, GATA3等) 和PrE基因 (GATA4, GATA6等) 的特异高表达和motif 富集。后续实验结果也发现这些细胞亚群能够分别被诱导成为有功能的滋养层干细胞 (TSC, trophoblast stem cell) 和胚外内胚层细胞 (extra-embryonic endoderm), 同时阴性细胞也能够在naïve培养条件下最终建立naïve态多能性转变为naïve态多能干细胞,充分展示了中间细胞亚群的可塑性。
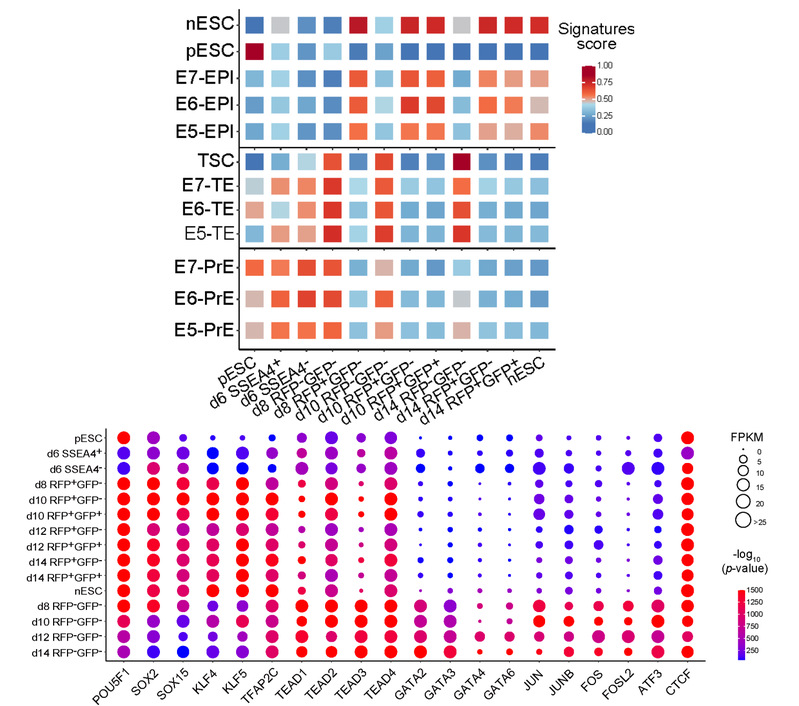
进一步,研究人员采用单细胞测序分析,同样证实在primed-to-naïve过程中出现了特异高表达TE信号 (TE signature) 和PrE信号 (PrE signature) 的细胞亚群, 并结合单细胞RNA速率分析 (RNA velocity) 以及轨迹推断分析 (PAGA, Partition-based graph abstraction),在单细胞水平上深层次的揭示了细胞亚群的动态变化以及细胞命运转变图谱。

综上所述,此项工作首次揭示了人细胞在primed-to-naïve诱导过程中的命运转变图谱,为naïve态多能性以及早期胚胎发育的研究提供了重要基础。同时本研究发现primed-to-naïve 转变过程中特定时间点同时出现滋养外胚层样 (TE-like) 和原始内胚层样 (PrE-like) 的异质性细胞群体,为人类胚胎(blastoid)体外构建提供重要的研究模型。
同济大学毕焱博士和博士生涂志奋为本文的共同第一作者,同济大学高绍荣教授和王译萱教授是本文的共同通讯作者。该研究得到了科技部、国家自然科学基金委以及上海市科委等项目的支持。
1Liu, X. et al. Reprogramming roadmap reveals route to human induced trophoblast stem cells. Nature 586, 101-107, doi:10.1038/s41586-020-2734-6 (2020).
2Bi, Y. et al. Identification of ALPPL2 as a Naive Pluripotent State-Specific Surface Protein Essential for Human Naive Pluripotency Regulation. Cell Rep 30, 3917-3931 e3915, doi:10.1016/j.celrep.2020.02.090 (2020).
 |
同济大学高绍荣课题组 地址:上海市四平路1239号同济大学,道交馆 邮编:200092 电话:021-65982276 |