
体细胞核移植(somatic cell nuclear transfer, SCNT)技术,也称克隆技术,指的是将终末分化的体细胞注入去核的卵母细胞内,使体细胞的染色质发生重编程并获得全能性的技术。然而,与正常胚胎相比,克隆胚胎的出生效率极低。供体细胞染色质的表观遗传重编程异常是导致这一现象的重要原因,其中就包括在供体细胞中高度富集的组蛋白H3第9位赖氨酸的三甲基化修饰(H3K9me3)。
2023年8月9日,同济大学生命科学与技术学院高绍荣/刘晓雨/李翀团队与江赐忠团队合作在Nature Communications杂志上在线发表题为Unreprogrammed H3K9me3 prevents minor zygotic genome activation and lineage commitment in SCNT embryos的研究论文。该研究首次描绘了小鼠克隆胚胎着床前发育过程中各阶段的H3K9me3修饰图谱,系统地揭示了H3K9me3修饰在重编程过程中的异常及调控机制,并鉴定出了多个与谱系特异性H3K9me3建立相关的调控因子,为提高克隆效率提供了新思路。

通过与正常胚胎进行比较,研究人员发现来源于供体细胞的H3K9me3在克隆胚胎发育过程中呈现整体偏高的状态。其中,H3K9me3异常富集在初级ZGA基因(minor ZGA,发生在小鼠1-细胞晚期至2-细胞早期)相关区域中,这与克隆胚胎中minor ZGA基因的转录抑制以及逆转座子的激活延迟密切关联。通过Kdm4b的过表达可特异性地擦除minor ZGA基因上的H3K9me3,从而恢复ZGA基因的激活。因此,H3K9me3的重编程异常是阻碍克隆胚胎获得全能性的一个重要因素。
此外,通过比较克隆胚胎与正常胚胎在囊胚阶段的H3K9me3富集区域的差异,研究人员发现,克隆囊胚在谱系特化过程中H3K9me3的建立存在严重异常。通过转录因子富集及转录活性差异的联合分析,预测出在差异化建立H3K9me3的区域中富集异常且表达紊乱的转录因子。
针对在克隆胚胎中异常低表达的转录因子Max和Mcrs1,在正常胚胎中对其进行敲降模拟验证,发现第一次谱系分化过程出现明显异常,表明Max和Mcrs1可能对克隆胚胎的谱系分化具有重要调控作用。在对克隆胚胎的发育挽救实验中,通过对Max和Mcrs1分别进行过表达,可促进克隆胚胎中谱系特异性H3K9me3的建立,并且显著改善克隆胚胎着床前后的发育潜能,进一步提高克隆小鼠的出生率。因此,本研究揭示了在分化过程中谱系特异性H3K9me3的建立缺陷是影响克隆胚胎发育的一个重要障碍。
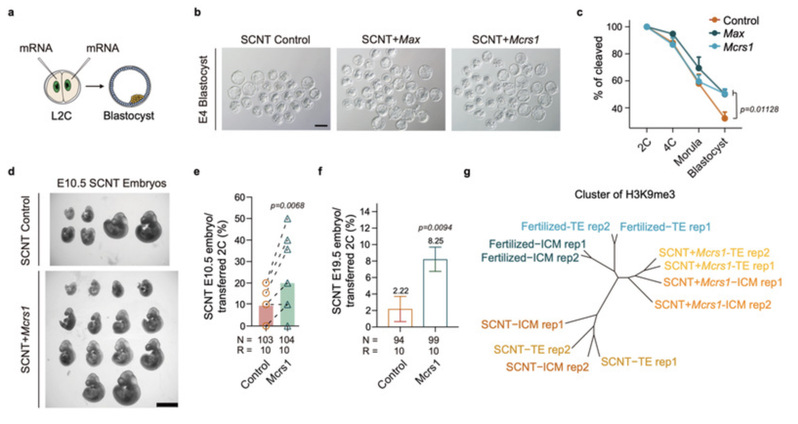
过表达Max和Mcrs1提高克隆胚胎的发育能力
综上,该研究解析了H3K9me3重编程的异常与克隆胚胎的全能性获得和谱系分化异常之间的关系,为理解克隆效率低下的分子机制提供了新的思路。
本文的第一作者是同济大学博士后徐睿敏和朱乾书。同济大学刘晓雨教授、高绍荣教授、同济大学附属第一妇婴保健院李翀副研究员与同济大学江赐忠教授是本文的共同通讯作者。
 |
同济大学高绍荣课题组 地址:上海市四平路1239号同济大学,道交馆 邮编:200092 电话:021-65982276 |