
2018年11月28日同济大学生命科学与技术学院高绍荣教授课题组与中科院生物物理所朱冰研究员课题组合作,在《Nature》杂志在线发表题为“Stella safeguards the oocyte methylome by preventing de novo methylation mediated by DNMT1”的研究论文,报道了Stella通过抑制DNMT1介导的起始性DNA甲基化,揭示卵子发生过程中DNA甲基化模式建立的机制。特别值得一提的是,该研究首次在体内证实了DNMT1可以作为起始性DNA甲基化转移酶,打破了教科书里关于DNMT1只是维持性DNA甲基化转移酶的论断。本项研究也是同济大学承担的国家重点研发计划干细胞及转化研究重点专项(2016YFA0100400)与创新研究群体项目(31721003)支持下,完成的第2篇Nature研究成果。
雌性哺乳动物的一生中只能提供有限数目的卵子,卵子的DNA甲基化水平很低,只有精子和绝大部分终末分化的体细胞的DNA甲基化水平的一半左右。然而,卵子的这种独特的DNA甲基化谱式的独特特征是怎样形成的,受哪些因子调控,又有着怎样的生物学意义却并不清楚。
在该研究团队的前期研究中,研究人员从小鼠卵细胞的cDNA文库中筛选鉴定到一个新型的DNA甲基化调控基因Stella。在体细胞中过表达Stella会通过与DNA甲基化调控因子UHRF1形成复合体,干扰DNA甲基化修饰在有丝分裂过程中的维持。由于Stella在卵母细胞的发育中高水平表达,在本工作中,研究人员进一步探索了Stella在卵母细胞成熟过程中的功能,发现Stella通过一个主动的出核转运过程,防止UHRF1在卵母细胞核内累积。研究发现,在敲除母源Stella后,有超过一半的胚胎发育停滞在2细胞向4细胞时期转变过程中,只有15%的胚胎能够发育至囊胚期。Stella敲除雌鼠的卵母细胞出现了异常的UHRF1核内累积、过度的DNA甲基化,并使成熟的卵子基因组甲基化水平翻倍,达到了与精子DNA甲基化相仿的水平。而同时敲除母源UHRF1和Stella后,约有40%能够发育至囊胚期。本研究进一步发现,Stella缺失导致的异常高甲基化主要发生在沉默的基因组区域,严重影响了成熟卵子的质量和受精后二细胞期胚胎的母源基因组激活。有趣的是,此前已知丧失了几乎所有DNA甲基化的卵子并不影响胚胎的着床前发育,因此科学界曾认为卵子特有的DNA甲基化状态并不重要。而本工作则表明,母源基因组特有的甲基化谱对于发育至关重要,但重要性并非在保障那些甲基化的区域,而是在保障那些非甲基化的区域处于这一独特的非甲基化状态。本研究揭示了卵子这一独特的基因组低甲基化状态的生物学意义。
此外,DNA甲基化酶DNMT1长期被认为是一个维持性甲基化酶,在细胞内仅能使用半甲基化的DNA作为底物。本研究发现,在Stella缺失的卵细胞中发生的异常甲基化是由DNMT1负责催化的,首次毫无异议地证明了DNMT1在体内具有不依赖于原有甲基化,而从头建立DNA甲基化的能力。该实验证据更充分证明了DNMT1能够在体内发挥较强的起始性DNA甲基转移酶活性,这一发现改写了教科书对DNA甲基化酶的分类。更重要的是,这一发现对DNMT1在体内多种已退出细胞周期的细胞类型(例如卵母细胞和神经元)中的高表达提供了功能解释的线索,对DNMT负责的DNA甲基化在衰老过程中的意义有着重要的启示。
中科院生物物理所朱冰研究课题组李颖峰博士、张珠强博士和同济大学高绍荣课题组陈嘉瑜博士为本文的共同第一作者,同济大学附属第一妇婴保健院的刘文强副研究员,以及同济大学生命科学与技术学院的博士生王明珠也参与了此项工作。该研究得到国家自然科学基金委、科技部、中国科学院和上海市科委等支持。 文章链接:https://www.nature.com/articles/s41586-018-0751-5
同济大学高绍荣教授课题组长期从事哺乳动物早期胚胎发育和体细胞重编程分子机制研究,并在早期胚胎发育的表观遗传调控机制、体细胞重编程的分子机制以及诱导多能干细胞多能性证明等多项研究中取得一系列重要进展,已经在包括Nature, Science, Nature Genetics, Cell Stem Cell、Nature Cell Biology等国际权威学术期刊发表论文130余篇。研究成果曾获得国家自然科学二等奖,“周光召基金会杰出青年基础科学奖”,“谈家桢生命科学创新奖”和“药明康德生命化学研究奖”等奖项。
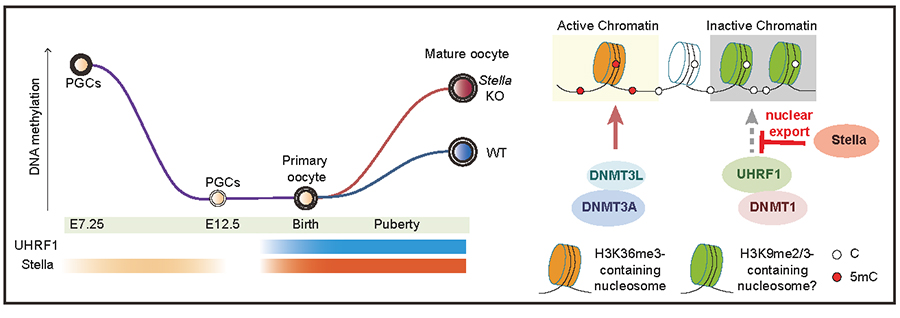
模式图: Stella 防止DNMT1介导的从头甲基化从而保证卵正常的甲基化组
 |
同济大学高绍荣课题组 地址:上海市四平路1239号同济大学,道交馆 邮编:200092 电话:021-65982276 |